2016年高考化学正在复习中,为了使同学们更好的复习高考化学,比网校在线高考网小编整理的《2016高考化学知识点:化学键类型》,供同学们参考学习。
化学键类型:离子键、共价键、配位键、金属键(氢键不是化学键)。
离子键
通过电荷转移而形成两种带相反电荷的离子,它们之间存在静电引力,这种键叫“离子键”。
例如:金属钠和氯气发生反应,生成氯化钠。
2Na+Cl2=2NaCl
钠的原子序数是11,其核外电子排布是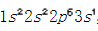 ,最外层有一个电子,容易失去一个电子形成稳定结构。氯的原子序数是17,其核外电子排布是
,最外层有一个电子,容易失去一个电子形成稳定结构。氯的原子序数是17,其核外电子排布是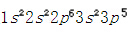 ,最外层有七个电子,容易得到一个电子形成稳定结构。从而钠失去一个电子,成为一个带正电荷的正离子,具有氖的电子构型;氯得到一个电子,成为一个带负电荷的负离子,具有氩的电子构型。最外层都达到八电子的稳定状态(八隅体)。钠正离子和氯负离子间存在静电吸引力,于是阴阳离子间形成了稳定的化学键。
,最外层有七个电子,容易得到一个电子形成稳定结构。从而钠失去一个电子,成为一个带正电荷的正离子,具有氖的电子构型;氯得到一个电子,成为一个带负电荷的负离子,具有氩的电子构型。最外层都达到八电子的稳定状态(八隅体)。钠正离子和氯负离子间存在静电吸引力,于是阴阳离子间形成了稳定的化学键。
共价键
由原子各提供的电子形成电子对,共享而形成的化学键叫“共价键”。例如CH4。
碳是位于元素周期表中第二周期第四族的元素,处于中间位置,外层有四个价电子,既不容易失去也不容易得到四个电子形成稳定的八电子结构。也就是说碳原子不可能形成C4+或C4-。因此,当碳原子和其他元素形成化合物时,为了要达到稳定的电子构型,就和其他原子各提供的电子形成两个原子共用的电子对。碳有四个单电子,它可以和四个氢原子形成四个共价键而生成甲烷。
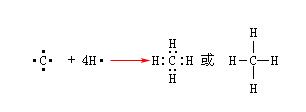
配位键
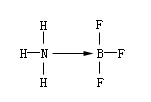
由一方原子提供电子而形成的化学键叫“配位键”。例如,三氟化硼和氨分子形成配位键。因为硼外层有三个电子,可以与三个氟原子形成三氟化硼(BF3),这样硼的外层共有六个电子,还有空轨道,还能容纳其他电子对。氨分子中的氨上有孤电子对,可以和硼结合形成配位键。
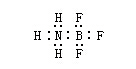
这种键是由一方提供电子给另一方,所以可以用箭头(→)表示,箭头所指方向是给电子方向或用下式表示:
再如胺生成铵盐的反应:
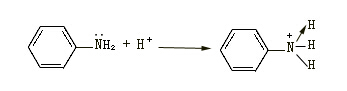
配位键也叫配位共价键,是属于共价键的一种。
下面把配位键与普通共价键和离子键作一比较。无论配位键或普通共价键,生成后在本质上并无差别,可用铵离子说明这一点。铵离子具有由氨分子未共用电子对和质子(H+)配位而形成的配位共价键,是正四面体结构,说明原来构成氨分子的三个N-H共价键和由于配位而形成的共价键,完全是等价的,所以共价键与配位键尽管在形成过程上有所不同,但键的本身并没有本质上的差别。
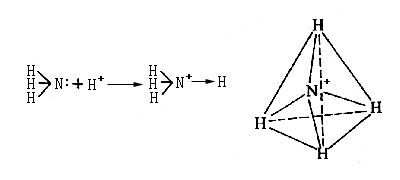
然而,配位键的形成是一种原子把电子给与另一种原子的过程,使成键的两个原子分别带有正负电荷。因此,配位共价键多数有极性,有时也叫做半极性键。极性的大小可以在偶极矩上反映出来,所以有配位键的化合物一般都有较大的偶极矩,而与离子键化合物的数值大小相当。因此,有配位键的化合物虽然是有机化合物,但却有难溶于有机溶剂而易溶于水和以高熔点的晶体形式存在等和盐类相似的性质。但配位键和离子键有本质上的不同,离子键是依赖于库仑静电引力结合起来的,而配位键除有库仑力外还有电子的离域力,所以有配位键的化合物,即使在水溶液里化学键也保持不变。例如,乙二胺四乙酸和钙离子反应生成盐的同时,还有由非常强的配位键生成的稳定的水溶性离子。这个络阴离子是稳定的,已不能与碳酸根离子生成沉淀,而且进行电解时含钙的组分移向阳极一侧。
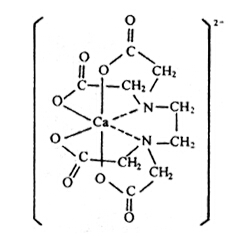
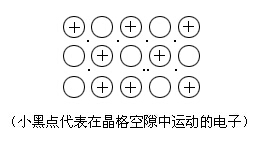
金属键
金属键是通过自由运动着的电子把金属内部的金属原子和金属离子结合在一起而成的键,如:
有机分子中的原子主要是以共价键相结合的,所以在有机化学中重点讨论的是共价键。
